ようこそ田内研究室のページへ
(茨城大学理学部 生物科学コース、大学院理工学研究科 量子線科学専攻)
Hiroshi Tauchi Laboratory, Ibaraki University

News 2021-2025
2025年 公開シンポジウムを開催しました
2025年2月9日(日) 理学部第8講義室にて
2023.11.8 研究室からの論文がJRR寺島論文賞を受賞
2021年日本放射線影響学会は9月に水戸市で開催しました。オンラインになりましたが、多数の参加をありがとうございました。
過去News
2020
4.15 ページを一新しました。
2011震災時の記事はArchiveにあります。
2.23 第13回Quantum Medicine研究会を開催
Q&A更新履歴(2015夏以降は更新をお休みしています)
2015
3.13 1年間の積算線量に4年目を追加しました
1.30 公開シンポジウムのご案内を掲載しました
2014
10.27 レポートとQ&Aの前書きを改訂しました
3.13 3年目の積算線量の変化を掲載しました
1.21 Q&A:一部補足を追記しました。
2013(主要な変更のみ)
9.10,17 Q&A:トリチウムと降下物の試算を掲載
4.22 被ばく影響の講演資料をQ&Aに公開しました
3.14 2年目の外部被ばく測定をまとめました
2012(主要な変更のみ)
8/1 Q&A:ストロンチウムについて追記しました
3/12 1年間の被ばくを掲載しました(3/15補正)
中・高校生の皆さんへ
復興と学び応援プロジェクト「今こそ、学問の話をしよう」にメッセージを掲載しました。
「ポスト3.11 変わる学問」 朝日新聞出版
「本当のところを教えて!放射線のリスク
放射線影響研究者からのメッセージ」
医療科学社から出版(2015年1月刊)
今後の一般講演先情報(提供)
現在は予定はありません。
理学部広報からのお知らせ
理学部公開シンポジウム開催
「放射線生体影響研究とがん放射線治療の接点」
2025年2月9日(日)理学部第8講義室
(近々に理学部HPに掲載します)

Professor: Hiroshi Tauchi, Ph.D.
Our research field
Radiation Biology, Molecular Biology, Cell Biology
研究分野:放射線生物学、分子生物学
[研究の概要]
細胞が遺伝子損傷を修復するしくみの研究
田内研究室では、ヒトやマウスなどの培養細胞を用いて、放射線や化学物質によって生じる遺伝子DNAの損傷(DNA分子の変化)を生体内で修復する機構について、細胞や生体分子(タンパク質)レベルで解明するための研究を行っています。特に、放射線に被ばくした細胞に発生するDNA鎖の切断について、細胞が修復する機構や、突然変異の発生に重点を置いています。遺伝子組換え技術を使って様々な細胞を作り出し、分子生物学的な解析手法で研究を進めています。
主な研究テーマと概要
1.放射線などで起きる遺伝子損傷の修復機構
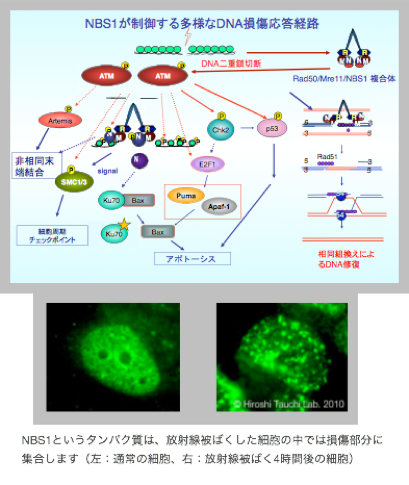
放射線に被曝すると、DNAに切断をはじめとした損傷が生じます。細胞はこの損傷をほとんど修復するのですが、その機構を特にNBS1というタンパク質に着目して調べています。
2.がん放射線治療に関する基礎研究
DNA損傷修復遺伝子の機能を利用して、がん放射線治療の改良につながる方策を考えるための基礎研究を行っています。
3.遺伝子の傷で引き起こされる突然変異の分子機構の解析
遺伝子損傷は時として遺伝子自体の変化、すなわち突然変異を引き起こしますが、そのような放射線などで起きる突然変異の発生機構について研究をしています。
がん放射線治療成績の向上へ、基礎からのサポート
放射線によるDNA損傷の修復機構をうまく調節することができれば、がん放射線治療をより効果が高く、正常組織への副作用が小さい方法へと改善することができるはずです。また、DNA損傷修復に関わる遺伝子の個人差とタンパク質機能との関係を解明することで、放射線に対する感受性の個人差や組織差をあらかじめ予見し、患者さん一人一人に合わせた放射線量や治療方法を設定する、オーダーメイド治療への展開も可能になるはずです。私たちは、基礎研究で得られた情報を、地域の医療・研究機関と共有し、連携するための組織「Quantum Medicine研究会」の事務局としても活動しています。
放射線に被ばくすると何が起きるのか?
放射線に被ばくした細胞には、遺伝子の本体であるDNAの損傷(物理・化学的変化)が起き、これが様々な障害の原因となります。放射線によるDNA損傷には、塩基損傷、DNA切断(一本鎖、二本鎖)などがありますが、通常起こるような少数のDNA損傷はほぼ全て修復されています。その一方で、修復不能となったり、修復ミスが起きてしまうと、細胞死、突然変異、染色体異常、発がんなどの誘因となります。細胞の中でDNAの損傷を修復するしくみはずいぶん明らかになってきましたが、未解明な点も多く残されています。
私たちの研究室で、特に注目しているのが、高発がん性の遺伝疾患である「ナイミーヘン症候群」に関わるNBS1というタンパク質です。NBS1というタンパク質は、通常は細胞核全体に分布していますが、DNA に損傷が入ると損傷部に集合して修復や細胞応答を制御します。写真は、その変化を蛍光免疫染色法で可視化したものです。私たちは NBS1が損傷部に他の修復タンパク質を集合させるのに機能する部分をはじめ、NBS1が制御するDNA修復機構が損傷を正確に直すタイプの「相同組換え」という機構であることや、発がんを抑えるために有効なアポトーシスという細胞死の制御にも機能していることを明らかにしてきました。
高発がん性の遺伝病、ナイミーヘン症候群の
原因遺伝子NBS1の機能解析
ナイミーヘン症候群は、オランダの都市ナイミーヘン(Nijmegen)大学の小児科医が初めて報告した、小頭症、高頻度のがん発症、放射線高感受性などを伴う世界でも希な遺伝疾患です。
患者で異常になっている遺伝子、NBS1は、DNA損傷の修復に重要な機能を持つことが明らかとなりつつあります。
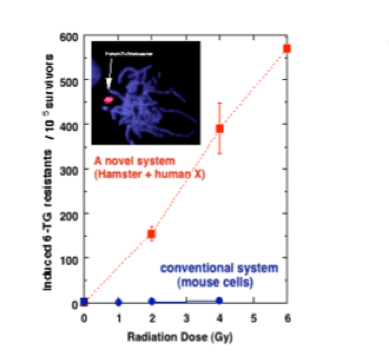
体細胞突然変異の高感度検出系の開発
放射線などで起きる遺伝子突然変異の発症機構についての研究も行っています。人工的に染色体を操作して作成したこの細胞は、通常の50~100倍の頻度で突然変異を起こします。この細胞系を使うことで、微量の変異原性物質の影響を評価することを目指しています。
研究室からの発表(共同研究も含めて一部のみを紹介します)
Tauchi, H., Kobayashi, J. ほか:Nbs1 is essential for DNA repair by homologous recombination in higher vertebrate cells. Nature 420, 93-98, 2002.
Iijima, K., Komatsu, K., Matsuura, S., Tauchi, H.: The Nijmegen breakage syndrome gene and its role in genome stability. Chromosoma 113, 53-61, 2004
田内 広:DNA損傷に対応する修復シグナルの概要.キーワードで理解する「細胞周期イラストマップ」中山敬一/編 羊土社2005年2月発行
Otsuka, K., Koana, T., Tauchi, H., Sakai, K.: Activation of Antioxidative Enzymes Induced by Low-Dose-Rate Whole-Body gamma Irradiation: Adaptive Response in Terms of Initial DNA Damage. Radiation Reserch 166, 474-478, 2006.
Sakamoto, S., Iijima, K., Mochizuki, D., Nakamura, K., Teshigawara, K., Kobayashi, J., Matsuura, S., Tauchi, H., Komatsu, K.: Homologous recombination repair is regulated by domains at the N- and C-terminus of NBS1 and is dissociated with ATM functions. Oncogene 26, 6002-6009, 2007
Akutsu, N., Iijima, K., Hinata, T. and Tauchi, H.: Characterization of the plant homolog of Nijmegen breakage syndrome 1: involvement in DNA repair and recombination. Biochemical and Biophysical Research Communications 353, 394-398, 2007.
Iijima, K., Muranaka, C., Kobayashi, J., Sakamoto, S., Komatsu, K., Matsuura, S., Kubota, N., Tauchi, H.: NBS1 regulates a novel apoptotic pathway through Bax activation. DNA Repair 7, 1705-1716, 2008.
Ohtsuka, K., Koana, T., Tomita, M., Ogata, H., Tauchi, H.: Rapid myeloid recovery as a possible mechanism of whole-body radioadaptive response. Radiation Research 170, 307-315, 2008.
Iijima, K., Ohara, M., Seki, R., Tauchi, H.: Dancing on damaged chromatin: Functions of ATM and the RAD50/MRE11/NBS1 complex in cellular responses to DNA damage. Journal of Radiation Research 49, 451-464, 2008.
Tauchi, H., Waku, H., Matumoto, E., Yara, S., Okumura, S.ほか.: Two major factors involved in the reverse dose-rate effect for somatic mutation induction are the cell cycle position and LET value. Journal of Radiation Research 50, 441-448, 2009.
Nakano, T., Katafuchi, A., Matsubara, M., Terato, H., Tsuboi, T., Masuda, T., Tatsumoto, M., Pack,S.-P. Makino, K., Croteau, D. L., Van Houten, B., Iijima, K., Tauchi, H., Ide, H.: Homologous recombination but not nucleotide excision repair plays a pivotal role in tolerance to DNA-protein crosslinks in mammalian cells. Journal of Biological Chemistry 284, 27065-27076, 2009.
Takagi, M., Sakata, K., Someya, M., Tauchi, H., Iijima, K., Matsumoto, Y., Torigoe, T., Takahashi, A., Hareyama, M., Fukushima, M.: Gimeracil sensitizes cells to radiation via inhibition of homologous recombination. Radiotherapy and Oncology 96, 259-266, 2010.
Tauchi, H., Imamura, H., Inoue, M., Komatsu, K., Tachibana, A.: Assessment of biological effect of tritiated water by using hypersensitive system. Fusion Science and Technology 60, 1173-1178, 2011.
Nakamura, K., Kato, A., Kobayashi, J., Yanagihara, H., Sakamoto, S., Oliveira, D.V.N.P., Shimada, M., Tauchi, H., Suzuki, H., Tashiro, S., Zou L., Komatsu, K.: Regulation of homologous recombination by RNF20-dependent H2B ubiquitination. Molecular Cell 41, 515-528, 2011.
Yanagihara, H., Kobayashi, J., Tateishi, S., Kato, A., Matsuura, S., Tauchi, H., Yamada, K., Takezawa, J., Sugasawa, K., Masutani, C., Hanaoka, F., Weemaes, C. M., Mori, T., Zou, L., Komatsu, K.: NBS1 recruits RAD18 via a RAD6-like motif and regulates Pol <eta>-dependent translesion DNA synthesis. Molecular Cell 43, 788-797, 2011.
Sakata, K., Someya, M., Matsumoto, Y., Tauchi, H., Kai, M., Toyota, M., Takagi, M., Hareyama, M., Fukushima, M.: Gimeracil, an inhibitor of dihydropyrimidine dehydrogenase, inhibits the early step in homologous recombination. Cancer Science 102: 1712-1716, 2011.
Ushigome, T., Shikazono, N., Fujii, K., Watanabe, R., Suzuki, M., Takakura, C., Tauchi, H., Yokoya A.: Yield of single-, double-strand breaks and nucleobase lesions in fully hydrated plasmid DNA films irradiated with high-LET charged particles. Radiation Research 177, 614-627, 2012
Oliveira, D.V., Kato, A., Nakamura, K., Ikura, T., Okada, M., Kobayashi, J., Yanagihara, H., Saito, Y., Tauchi, H., Komatsu, K.: Histone chaperone FACT regulates homologous recombination by chromatin remodeling through interaction with RNF20. Journal of Cell Science 127:763-772, 2014
Ohara, M., Funyu, Y., Ebara, S., Sakamoto, Y., Seki, R., Iijima, K., Ohishi, A., Kobayashi, J., Komatsu, K., Tachibana, A., Tauchi, H.: Mutations in the FHA-domain of ectopically expressed NBS1 lead to radiosensitization and to no increase in somatic mutation rates via a partial suppression of homologous recombination. Journal of Radiation Research 55, 690-698, 2014.
Nagashima, H.,Shiraishi, K., Ohkawa, S., Sakamoto, S., Komatsu, K., Matsuura, S., Tachibana, A., Tauchi, H.: Induction of somatic mutation by low dose X-rays: the challenge in recognizing radiation-induced events. Journal of Radiation Research 59, ii75-ii83, 2018.
Sakamoto, Y, Kokuta, T., Teshigahara, A., Iijima, K., Kitao, H., Takata, M., Tauchi, H., Mitotic cells can repair DNA double strand breaks via a homology-directed pathway. Journal of Radiation Research 62, 25-33, 2021.
Nagashima, H., Hayashi, Y., Sakamoto, Y., Komatsu, K., Tauchi, H.: Induction of somatic mutations by low concentrations of tritiated water (HTO): evidence for the possible existence of a dose-rate threshold. Journal of Radiation Research,62, 582-589, 2021
Tomioka K., Miyamoto T., Akutsu S.N., Yanagihara H., Fujita K., Royba E., Tauchi H., Yamamoto T., Koh I., Hirata E., Kudo Y., Kobayashi M., Okada S., Matsuura S.: NBS1 I171V variant underlies individual differences in chromosomal radiosensitivity within human populations. Scientific Reports DOI : 10.1038/s41598-021-98673-7, 2021.
Nagashima, H., Hayashi, Y., Tanimoto, S., Tauchi, H.: Dose and dose-rate dependence of DSB-type mutants induced by X-rays or tritium beta-rays: An approach using a hyper-sensitive system. Radiation Protection Dosimetry 198, 1009-1013, 2022.
Komatsu K, Tauchi H.: Mechanistic insights into the survival curve of HeLa cells with a short shoulder and their S phase-specific sensitivity. (Letter to Editor) Journal of Radiation Research 65, 256-258, 2023.
Someya M, Hasegawa T, Nakamura AJ, Tsuchiya T, Kitagawa M, Gocho T, Mafune S, Ikeuchi Y, Tauchi H, Sakata KI.: Prediction of late adverse events in pelvic cancer patients receiving definitive radiotherapy using radiation-induced gamma-H2AX foci assay. Journal of Radiation Research 64,948-953,2023
Ebara S., Yoshida M. Yamakawa H., Shimokawa K., Inoue Y., Tauchi H., Morishita D.: Interaction of CDK12 with NXF1 is a new node for the linking mechanism between transcription and transportation of mRNA. Biochemical and Biophysical Research Communications 735, 150608, 2024
Myodo T., Sakamoto Y., Sato K., Kobayashi H., Iijima K., Komatsu K., Matsuura S., Tauchi H.: Effect of PI3-kinase inhibitors on DNA double stand break repair pathways: Observations using a site specific DSB induction system. Radiation Protection Dosimetry 200(16-18), 1598-1602 2024.
.
